来源:EngineeringForLife
关节软骨作为无血管组织,自我修复能力极差,不仅会引发疼痛、关节功能障碍,甚至可能导致永久性残疾。损伤部位活性氧簇 (ROS)
积聚会加重炎症反应,进一步阻碍愈合进程。干细胞疗法是潜力解决方案,其中滑液来源间充质干细胞 (SF-MSCs)
因其易获取、强成软骨分化能力而具有广泛前景,但依然存在注射易受损、移植后易纤维化等问题,故亟需开发合适的微创注射载体。
水凝胶因其高含水量、可调力学性能、良好的生物相容性和生物降解性,已成为理想的干细胞递送载体。然而,传统块状水凝胶存在营养供应不足、难用于微创治疗等问题,促使研究者转向具有大比表面积等特点的微球系统。传统微球制备技术(如批量乳化法)存在产量低、细胞存活率不高等问题。相比之下,投影式光固化(DLP)生物3D打印技术可高效、均一地制备微球,更好地保障细胞与药物活性。基于此开发的生物活性微球系统,为SF-MSCs提供了适宜的生长环境,有望有望突破其临床应用瓶颈。 论文题目:3D printing programmed diagnostic and therapeutic
bioactive“all-in-one”microspheres with multistimuli responsiveness for
cartilage regeneration
DOI:10.1016/j.cej.2025.163898
发表期刊:Chemical Engineering Journal ( IF 13.2 )
投影式光固化生物3D打印机
本研究开发了一种生物活性 “一体化” 微球 (MSs) 系统,用于微创软骨再生。该团队采用新型投影式光固化(DLP)生物3D打印技术,以
GelMA/HANB/TA 为仿生生物墨水,整合滑液来源间充质干细胞(SF-MSCs)
和负载软骨生成素(KGN)的聚乳酸-乙醇酸共聚物(PLGA)纳米颗粒制备微球。该技术可在几秒内批量打印数千个微球,无剪切力影响且细胞存活率高,微球兼具病理信号“诊断”和药物缓释“治疗”双重逻辑,还具备组织粘附、抗氧化、抗炎特性,能通过CCN1/CYR61介导的integrin/PI3K/Akt信号通路促进
SF-MSCs软骨分化,延长关节滞留时间(图1)。

主要内容
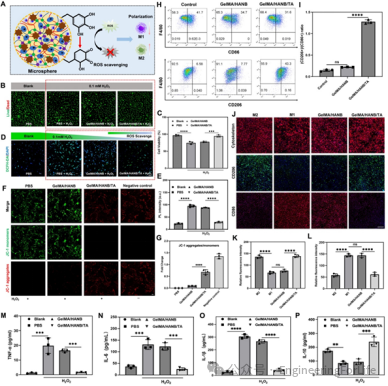
GelMA/HANB/TA水凝胶生物墨水中的单宁酸 (TA) 具有优异的自由基清除能力,对 ABTS+・、DPPH・和超氧阴离子自由基
(O₂・⁻) 的清除效率均较高。在过氧化氢 (H₂O₂) 模拟的氧化应激环境中,该水凝胶能有效保护 SF-MSCs 存活,细胞存活率达
94.94±2.57%,且能减少细胞内 ROS 积累、维持线粒体膜电位稳定。同时,它可调控巨噬细胞表型转换,显著增加 M2 型巨噬细胞标志物
CD206 的表达,降低 M1型标志物 CD86 的表达,还能抑制肿瘤坏死因子-α(TNF-α)、白细胞介素 -1β(IL-1β) 和白细胞介素
– 6(IL-6) 等促炎因子的分泌,提高抗炎因子白细胞介素 -10(IL-10) 的水平,展现出良好的免疫调节和抗炎效果(图2)。
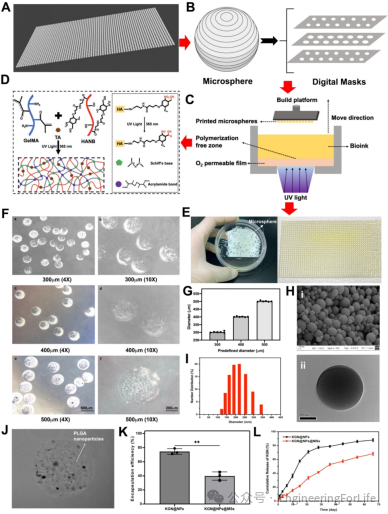
通过DLP生物3D打印技术,以GelMA/HANB/TA为生物墨水,经紫外光照射快速交联,采用“自下而上”的层叠打印方式,几秒内即可制备数千个尺寸均一的微球。打印微球可定制300
μm、400 μm和500 μm等不同直径,直径偏差最大不超过10%。通过乳液法合成的负载KGN的PLGA纳米颗粒呈球形,平均直径230
nm,将其均匀混入生物墨水中打印形成“一体化”微球后,KGN
的封装效率虽有下降,但能实现长效缓释,避免突释现象,为软骨再生提供持续的生物活性信号(图3)。
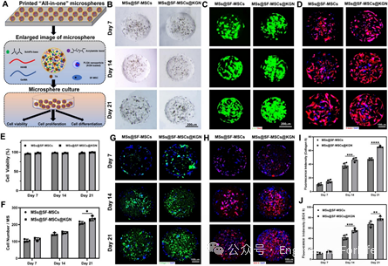
从骨关节炎患者滑液中分离的SF-MSCs,经鉴定表达CD90、CD105、CD73等干细胞标志物,且具有三系分化潜能。将其负载于“一体化”微球后,在体外培养21天期间细胞生长增殖良好,存活率始终保持在95%以上,细胞能在微球内形成空间分布。与不含KGN的微球组相比,负载KGN的微球组(MSs@SF-MSCs@KGN)能显著上调软骨分化关键标志物Ⅱ型胶原蛋白(COL2)和性别决定区Y框蛋白9(SOX9)的表达,同时增加胶原蛋白和糖胺聚糖(GAG)
的积累,明确证明KGN能有效诱导SF-MSCs向软骨细胞分化(图4)。
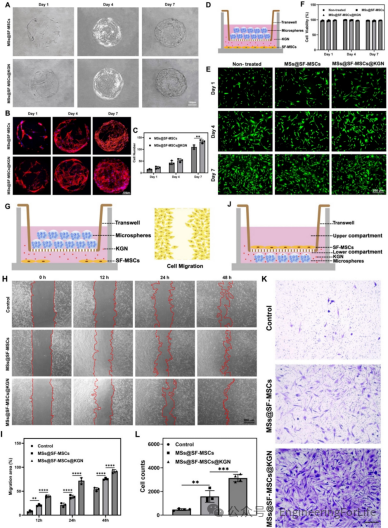
打印微球具有良好的生物相容性,SF-MSCs能快速粘附在微球表面并持续增殖,细胞数量随培养时间逐渐增加。在Transwell共培养体系中,SF-MSCs的存活率始终保持在95%以上,证实微球对细胞无毒性。伤口愈合实验和Transwell迁移实验结果显示,MSs@SF-MSCs@KGN组的细胞迁移速度显著快于对照组和不含KGN的微球组,表明该微球系统能有效招募宿主细胞向软骨缺损部位迁移,为组织修复提供充足细胞来源(图5)。
体外软骨分化诱导实验中,MSs@SF-MSCs@KGN组的SF-MSCs经 Safranin O和Alcian
blue染色后,阳性信号显著强于其他两组,表明软骨基质合成更为丰富。免疫荧光染色结果显示,该组细胞中COL2和SOX9的荧光强度明显升高,实时荧光定量PCR
(RT-qPCR)
检测进一步证实COL2、SOX9和聚集蛋白聚糖(Aggrecan)等软骨分化相关基因的表达水平显著上调,充分说明微球缓释的KGN能有效促进SF-MSCs的软骨分化(图6)。
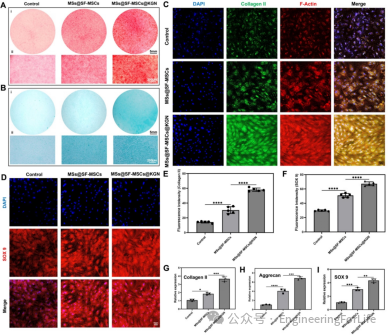
转录组测序(RNA-seq)分析显示,与2D培养相比,SF-MSCs在微球系统(尤其是负载KGN的微球系统)
中出现大量差异表达基因(DEGs),这些基因主要富集在细胞粘附、细胞外基质组织、细胞增殖调控等生物学过程。KEGG通路分析表明,PI3K-Akt信号通路、focal
adhesion等通路被显著激活。WB验证显示,MSs@SF-MSCs@KGN组中CCN1/CYR61、磷酸化PI3K(p-PI3K)
、磷酸化 Akt(p-Akt)的蛋白水平显著升高,同时COL2和SOX9的表达也明显上调,证实微球通过CCN1/CYR61介导的下游
integrin/PI3K/Akt信号通路促进 SF-MSCs软骨分化(图7)。
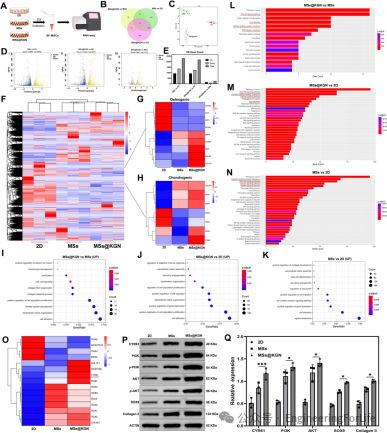
荧光成像技术追踪显示,经Cy5.5标记的 “一体化”
微球注射到大鼠关节腔后,能持续滞留长达25天,而单纯注射的SF-MSCs在7天后荧光信号即显著减弱。对大鼠主要脏器的离体荧光成像结果表明,微球主要集中在关节腔部位,全身分布较少,这一特性保证了KGN在关节局部的长效缓释,为软骨修复提供持续的治疗效果(图8)。
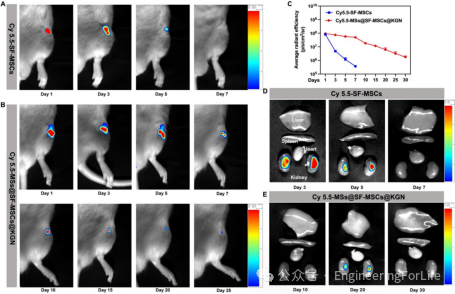
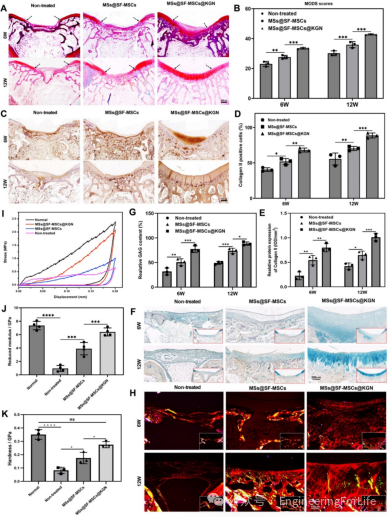
在新西兰大白兔膝关节骨软骨缺损模型中,术后6周和12周的大体观察显示,MSs@SF-MSCs@KGN组的缺损部位被光泽洁白的组织充分填充,与周围正常组织整合良好,国际软骨修复学会(ICRS)评分显著高于对照组和不含KGN的微球组。micro-CT扫描和三维重建结果显示,该组缺损区域的新生骨体积(BV)
、骨体积分数(BV/TV)和骨小梁数量(Tb.N)均显著增加,骨小梁分离度(Tb.SP)
降低,表明微球能有效促进软骨下骨再生,为软骨修复提供良好的力学支撑(图9)。
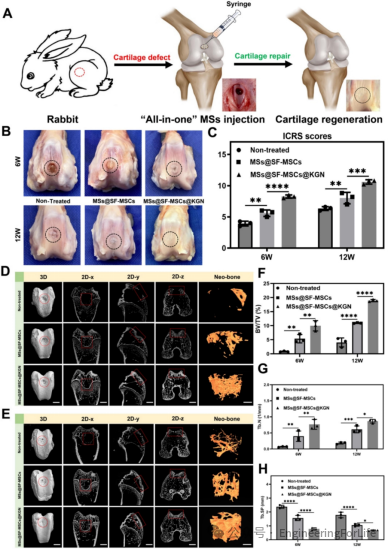
组织学染色结果显示,MSs@SF-MSCs@KGN组术后12周的修复组织经Safranin O和Alcian
blue染色呈强阳性,GAG含量显著高于其他两组,且Ⅱ型胶原蛋白免疫组化染色阳性细胞大量聚集,修复组织与正常软骨界面无缝整合,改良
O’Driscoll组织学评分(MODS)最高。生物力学测试表明,该组修复软骨的应力值、弹性模量和硬度均显著高于对照组,且接近正常软骨水平,具备承受外界压力的力学性能,满足生理功能需求(图10)。
未来展望
3D打印与生物活性“一体化”微球的结合,为骨修复带来革命性前景。3D打印的快速批量生产、尺寸精准可控优势,让微球能按需定制直径与性能,适配不同关节软骨缺损及力学需求,还可整合自体干细胞实现个性化制备。微球则凭借干细胞递送、药物长效缓释、抗炎抗氧化等功能,协同促进软骨-软骨下骨同步再生,通过微创注射即可完成治疗。两者联用既打破传统骨修复创伤大、效果有限的瓶颈,又能推动骨关节炎、创伤性骨软骨缺损等疾病的精准治疗,加速微创化、定制化骨修复方案的临床转化,成为再生医学领域的核心突破方向。



0 留言